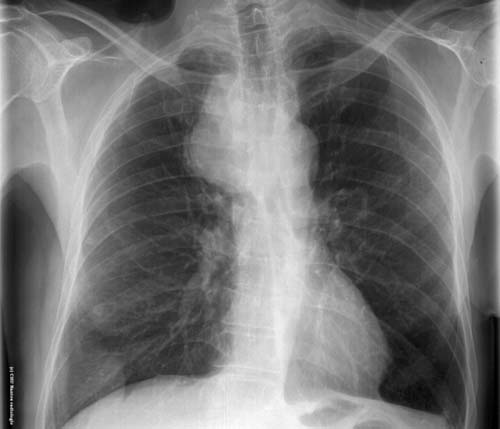
As complicações intracranianas (CIC) das rinossinusites são a extensão do processo infeccioso para estruturas adjacentes, ocorrendo em um pequeno, mas significante número de pacientes. Dentre as de origem
nasossinusal são citadas empiema subdural, abscesso cerebral, meningite e abscesso extradural como as formas mais comumente encontradas.
Os empiemas, dentre as CIC, podem se apresentar desde simples cefaléia até manifestações mais graves como hemiparesias, convulsões e alterações de consciência. O diagnóstico dessa afecção é baseado na suspeita clínica, associada a exames de imagem, sendo a tomografia computadorizada (TC) o primeiro exame na abordagem desses pacientes.
No entanto, a ressonância magnética (RM) permanece o padrão ouro para o diagnóstico de qualquer CIC (2). O tratamento dessa complicação é baseado em antibioticoterapia de amplo espectro associada, na maioria dos casos, à abordagem cirúrgica tanto otorrinolaringológica quanto neurológica.
"Para ganhar conhecimento, adicione coisas todos os dias. Para ganhar sabedoria, elimine coisas todos os dias." Lao-Tsé
quinta-feira, 30 de setembro de 2010
sábado, 25 de setembro de 2010
Melanoma Cutâneo
O melanoma cutâneo (MC) representa 6% dos tumores de pele, com incidência crescente de aproximadamente 70.000 casos novos por ano na população mundial. Por se tratar de tumor agressivo, o diagnóstico precoce e o tratamento adequado constituem as melhores armas terapêuticas para seu controle devido a altos riscos de metástases linfáticas e hematogênicas. Aspectos Clínicos Os dois fatores mais importantes na etiologia do melanoma são: exposição solar e tipo de pele do indivíduo. Pacientes caucasóides com pele, cabelos e olhos claros que apresentam queimaduras solares em vez de bronzear-se (pele avermelhada ou com formação de bolhas precocemente), têm maior fator de risco para ocorrência de tumores na pele (também chamado “grupo de risco”), ao se exporem cronicamente aos raios ultravioleta tipo A e B.O MC acomete ambos os sexos em igual proporção, sendo no homem mais comum no dorso e na mulher nos membros inferiores . Lesões cutâneas pigmentadas em que ocorram alterações no tamanho, cor, aspecto dos bordos, principalmente se associados a prurido e/ou sangramento devem ter alto índice de suspeição. História familiar de MC e presença de nevos displásicos também são fatores de risco.
Aspectos histopatológicos
O microestadiamento após biópsia da lesão, é feito através das medidas de Breslow (espessura vertical da lesão em milímetros em que se mede a partir da camada granulosa até o ponto de maior penetração na profundidade) e da invasão do tumor nas diferentes camadas da pele (da epiderme até o subcutâneo) chamados de níveis de Clark, que vão de I a V.
Diagnóstico
Na vigência de lesão suspeita, realizamos biópsia. Esta deve ser profunda o suficiente para seu microestadiamento sempre baseado nos níveis de Clark e Breslow. Deve-se dar preferência à biópsia excisional para tumores com até 2 cm de extensão na superfície da pele. As margens desta biópsia deve ser entre 1 e 3 mm das bordas da lesão. Tumores em face, palma da mão, sola do pé, subungueal e lesões maiores que 2,0cm, deve-se realizar biópsia incisional.
Aspectos histopatológicos
O microestadiamento após biópsia da lesão, é feito através das medidas de Breslow (espessura vertical da lesão em milímetros em que se mede a partir da camada granulosa até o ponto de maior penetração na profundidade) e da invasão do tumor nas diferentes camadas da pele (da epiderme até o subcutâneo) chamados de níveis de Clark, que vão de I a V.
Diagnóstico
Na vigência de lesão suspeita, realizamos biópsia. Esta deve ser profunda o suficiente para seu microestadiamento sempre baseado nos níveis de Clark e Breslow. Deve-se dar preferência à biópsia excisional para tumores com até 2 cm de extensão na superfície da pele. As margens desta biópsia deve ser entre 1 e 3 mm das bordas da lesão. Tumores em face, palma da mão, sola do pé, subungueal e lesões maiores que 2,0cm, deve-se realizar biópsia incisional.
Pneumoconioses
As pneumopatias relacionadas etiológicamente à inalação de poeiras em ambientes de trabalho são genericamente designadas como pneumoconioses (do grego, conion = poeira). São excluídas dessa denominação as alterações neoplásicas, as reações de vias aéreas, como asma e a bronquite, e o enfisema. Apesar de esse conceito englobar a maior parte das alterações pulmonares envolvendo o parênquima, alguns autores apontam para o fato de que o termo pneumoconiose pode não ser adequado quando aplicado a determinadas pneumopatias mediadas por processos de hipersensibilidade atingindo o parênquima pulmonar,
como as alveolites alérgicas por exposição a poeiras orgânicas e outros agentes, a doença pulmonar pelo berílio, ou a pneumopatia pelo cobalto, por exemplo.
Essas considerações têm importância quando se estudam os processos fisiopatogênicos subjacentes a essas doenças. Para fins práticos, no entanto, o termo pneumoconiose será utilizado neste protocolo para designar genericamente todas as doenças pulmonares parenquimatosas causadas por inalação de poeiras independente do processo fisiopatogênico envolvido. As pneumoconioses podem, didaticamente, ser divididas em fibrogênicas e não fibrogênicas de acordo com o potencial da poeira em produzir fibrose reacional. Apesar de existirem tipos bastante polares de pneumoconioses fibrogênicas e não fibrogênicas, como a silicose e a asbestose, de um lado, e a baritose, de outro, existe a possibilidade fisiopatogênica de poeiras tidas como não fibrogênicas produzirem algum grau de fibrose dependendo da dose, das condições de exposição e da origem geológica do material.
sábado, 18 de setembro de 2010
Pigmentação patológica
SÃO SUBSTÂNCIAS EXÓGENAS OU ENDÓGENAS QUE IMPREGNAM OS TECIDOS CONFERINDO-LHES COR.
a) EXÓGENOS
1. ANTRACOSE: PIGMENTO DE CARVÃO
ORIGEM: INALAÇÃO DE FUMAÇAS, FUMO, POLUIÇÃO AMBIENTAL
MECANISMO E DESTINO:
INALAÇÃO DE PARTÍCULAS SÓLIDAS QUE IRÃO PARA: ALVÉOLOS, MACRÓFAGOS, LINFÁTICOS ,LINFONODOS (PRETOS) E PLEURA (MANCHAS PRETAS).
MACRÓFAGOS: “DUST-CELLS” VISTOS NO citopatológico DE ESCARRO.
OBS.: MINEIROS DE MINAS DE CARVÃO FARÃO PNEUMOCONIOSE (FIBROSE PULMONAR
OCUPACIONAL PELA SÍLICA)
2. TATUAGEM:
GRÂNULOS CORADOS INOCULADOS NA PELE (DESENHOS/FIGURAS).
DESTINO: AO LONGO DE FIBRAS
COLÁGENAS E EM MACRÓFAGOS FIXOS.
b) ENDÓGENOS
1. LIPOFUSCINA:
DEFINIÇÃO: PIGMENTO DO DESGASTE CELULAR (ENVELHECIMENTO) DA ATROFIA PARDA (SENIL).
COMPOSIÇÃO: LIPO-PROTEÍNA DERIVADA DE LIPÍDEOS DA MEMBRANA CELULAR.
ÓRGÃOS MAIS COMUNS: FÍGADO, CORAÇÃO, CÉREBRO
MORFOLOGIA:
MICROSCOPIA: GRÂNULOS PARDOS CITOPLASMÁTICOS, PARANUCLEARES.
MACROSCOPIA:
FÍGADO:TAMANHO MENOR, COLORAÇÃO PARDO-ESCURA ( CHARUTO ), SEMELHANTE NA SUPERFÍCIE DE CORTE.
CORAÇÃO:VOLUME MENOR, COR PARDO-ESCURA COM CORONARIASTORTUOSAS, “SERPIGINOSAS”
2 -MELANINA:
SÍTIOS FISIOLÓGICOS:MELANÓCITOS:
PELE, RETINA, BEXIGA, TUBO DIGESTIVO, ADRENAIS, MENINGES
ASPECTO MACROSCÓPICO DO TECIDO:
MARRON A PRETO
MICROSCÓPICO:MARRON A PRETO, REAÇÃO DE PERLS NEGATIVA (FICAMARRON).
Pigmentos e Pigmentação Patológica
•Função da melanina: proteção da pele
•Diferença de cor da pele: quantidade demelanina produzida
•Melanócitos: influênciada RUV, hormonais e genéticas
Influências hormonais e genéticas:
–O MSH estimula produção de melanina pelos melanócitos.O MSH é parecido com o ACTH.
–Doença de Addison: destruição adrenais, sobra ACTH que produz hiperpigmentação.
–Melasma ( Cloasma gravídico ): gravidez
–Albinismo: deficiência de tirosinase
–Vitiligo: destruição dos melanócitos
3.HEMOSSIDERINA:
ORIGEM:PIGMENTO HEMOGLOBÍNICO FORMADO NA PRESENÇA DE OXIGÊNIO, OBRIGATORIAMENTE INTRACELULAR (EXTRACELULAR –É DISSOLVIDO).
ASPECTOS MICROSCÓPICOSEM MACRÓFAGOS OU CÉLULAS EPITELIAIS (HEPATÓCITOS, CÉLULAS TUBULARES RENAIS, TUBO DIGESTIVO, PULMÃO PIGMENTO GRANULAR, MARRON-AMARELADO (PARDO) REAÇÃO DE PERLS +, FICA AZUL.
4-Hematina
PIGMENTO DERIVADO DA HEMOGLOBINA, FORMADO NA PRESENÇA DE ACIDOS OU BASES FORTES.
CAUSA:SANGRAMENTO DIGESTIVO ALTO (GASTRITE AGUDA EROSIVA, ÚLCERAS, EROSÕES).
APRESENTAÇÃO:VÔMITOS EM “BORRA-DE-CAFÉ” (PIGMENTO PRETO DE HEMATINA).
5-BILIRRUBINA:
PIGMENTO DA ICTERÍCIA.
ICTERÍCIA:PIGMENTAÇÃO AMARELA DA PELE, ESCLERÓTICA DO OLHO (CONJUNTIVA) E ÓRGÃOS INTERNOS. Elastina afim !
CAUSAS:AUMENTO DE BILIRRUBINAS DIRETA ( conjugada ) e INDIRETA ( não conjugada ).
Icterícia: elevação dos níveis de bilirrubina no plasma com impregnação na pele e nos tecidos, PIGMENTAÇÃO AMARELA DA PELE, ESCLERÓTICA DO OLHO (CONJUNTIVA) E ÓRGÃOS INTERNOS.
COLESTASE: RETENÇÃO DE PIGMENTO BILIAR NO FÍGADO EM COLANGIOLOS, DUCTOS BILIARES OU HEPATÓCITOS DE CAUSA INTRA OU EXTRA-HEPÁTICA, PODENDO-SE ACOMPANHAROU NÃO DE ICTERÍCIA.
a) EXÓGENOS
1. ANTRACOSE: PIGMENTO DE CARVÃO
ORIGEM: INALAÇÃO DE FUMAÇAS, FUMO, POLUIÇÃO AMBIENTAL
MECANISMO E DESTINO:
INALAÇÃO DE PARTÍCULAS SÓLIDAS QUE IRÃO PARA: ALVÉOLOS, MACRÓFAGOS, LINFÁTICOS ,LINFONODOS (PRETOS) E PLEURA (MANCHAS PRETAS).
MACRÓFAGOS: “DUST-CELLS” VISTOS NO citopatológico DE ESCARRO.
OBS.: MINEIROS DE MINAS DE CARVÃO FARÃO PNEUMOCONIOSE (FIBROSE PULMONAR
OCUPACIONAL PELA SÍLICA)
2. TATUAGEM:
GRÂNULOS CORADOS INOCULADOS NA PELE (DESENHOS/FIGURAS).
DESTINO: AO LONGO DE FIBRAS
COLÁGENAS E EM MACRÓFAGOS FIXOS.
b) ENDÓGENOS
1. LIPOFUSCINA:
DEFINIÇÃO: PIGMENTO DO DESGASTE CELULAR (ENVELHECIMENTO) DA ATROFIA PARDA (SENIL).
COMPOSIÇÃO: LIPO-PROTEÍNA DERIVADA DE LIPÍDEOS DA MEMBRANA CELULAR.
ÓRGÃOS MAIS COMUNS: FÍGADO, CORAÇÃO, CÉREBRO
MORFOLOGIA:
MICROSCOPIA: GRÂNULOS PARDOS CITOPLASMÁTICOS, PARANUCLEARES.
MACROSCOPIA:
FÍGADO:TAMANHO MENOR, COLORAÇÃO PARDO-ESCURA ( CHARUTO ), SEMELHANTE NA SUPERFÍCIE DE CORTE.
CORAÇÃO:VOLUME MENOR, COR PARDO-ESCURA COM CORONARIASTORTUOSAS, “SERPIGINOSAS”
2 -MELANINA:
SÍTIOS FISIOLÓGICOS:MELANÓCITOS:
PELE, RETINA, BEXIGA, TUBO DIGESTIVO, ADRENAIS, MENINGES
ASPECTO MACROSCÓPICO DO TECIDO:
MARRON A PRETO
MICROSCÓPICO:MARRON A PRETO, REAÇÃO DE PERLS NEGATIVA (FICAMARRON).
Pigmentos e Pigmentação Patológica
•Função da melanina: proteção da pele
•Diferença de cor da pele: quantidade demelanina produzida
•Melanócitos: influênciada RUV, hormonais e genéticas
Influências hormonais e genéticas:
–O MSH estimula produção de melanina pelos melanócitos.O MSH é parecido com o ACTH.
–Doença de Addison: destruição adrenais, sobra ACTH que produz hiperpigmentação.
–Melasma ( Cloasma gravídico ): gravidez
–Albinismo: deficiência de tirosinase
–Vitiligo: destruição dos melanócitos
3.HEMOSSIDERINA:
ORIGEM:PIGMENTO HEMOGLOBÍNICO FORMADO NA PRESENÇA DE OXIGÊNIO, OBRIGATORIAMENTE INTRACELULAR (EXTRACELULAR –É DISSOLVIDO).
ASPECTOS MICROSCÓPICOSEM MACRÓFAGOS OU CÉLULAS EPITELIAIS (HEPATÓCITOS, CÉLULAS TUBULARES RENAIS, TUBO DIGESTIVO, PULMÃO PIGMENTO GRANULAR, MARRON-AMARELADO (PARDO) REAÇÃO DE PERLS +, FICA AZUL.
4-Hematina
PIGMENTO DERIVADO DA HEMOGLOBINA, FORMADO NA PRESENÇA DE ACIDOS OU BASES FORTES.
CAUSA:SANGRAMENTO DIGESTIVO ALTO (GASTRITE AGUDA EROSIVA, ÚLCERAS, EROSÕES).
APRESENTAÇÃO:VÔMITOS EM “BORRA-DE-CAFÉ” (PIGMENTO PRETO DE HEMATINA).
5-BILIRRUBINA:
PIGMENTO DA ICTERÍCIA.
ICTERÍCIA:PIGMENTAÇÃO AMARELA DA PELE, ESCLERÓTICA DO OLHO (CONJUNTIVA) E ÓRGÃOS INTERNOS. Elastina afim !
CAUSAS:AUMENTO DE BILIRRUBINAS DIRETA ( conjugada ) e INDIRETA ( não conjugada ).
Icterícia: elevação dos níveis de bilirrubina no plasma com impregnação na pele e nos tecidos, PIGMENTAÇÃO AMARELA DA PELE, ESCLERÓTICA DO OLHO (CONJUNTIVA) E ÓRGÃOS INTERNOS.
COLESTASE: RETENÇÃO DE PIGMENTO BILIAR NO FÍGADO EM COLANGIOLOS, DUCTOS BILIARES OU HEPATÓCITOS DE CAUSA INTRA OU EXTRA-HEPÁTICA, PODENDO-SE ACOMPANHAROU NÃO DE ICTERÍCIA.
Calcificações Patológicas
Calcificação é um fenômeno bioquímico caracterizado pela deposição de sais de cálcio em qualquer parte do organismo. O mecanismo das calcificações segue o princípio de que um núcleo inicial é formado nas mitocôndrias, sede dos depósitos normais de cálcio na célula, quando esta entra em contato com altas concentrações desse íon no citosol ou no líquido extracelular . A deposição de cálcio normal ocorre durante a formação dos tecidos ósseos e dentários. Calcificações patológicas, referidas como heterotópicas, ocorrem devido a alterações metabólicas celulares que induzem a uma deposição anormal de sais de cálcio e outros sais em locais onde não é comum a sua deposição . As calcificações patológicas podem ser classificadas em distróficas, idiopáticas e metastáticas.
A calcificação distrófica ocorre quando não há suprimento sanguíneo suficiente, e tecidos necróticos e isquêmicos estão presentes. Ocorre geralmente, no centro de tumores em crescimento, onde se observa a diminuição da respiração celular, redução na produção de dióxido de carbono e aumento na alcalinidade do fluido extracelular, resultando na formação de um microambiente em que o cálcio é facilmente depositado. Os níveis do cálcio sanguíneo são normais. Tal condição pode não produzir sinais e sintomas, porém induzem, ocasionalmente, ao edema e à ulceração dos tecidos. As massas calcáreas podem ser palpadas. São exemplos de calcificações distróficas as dos nódulos linfáticos, os tonsilolitos e as calcificações de vasos sanguíneos como as da artéria carótida.
Calcificações idiopáticas são as que ocorrem em tecidos normais, na presença de níveis normais de cálcio sanguíneo. São exemplos os sialolitos e os flebolitos. A calcificação metastática consiste na deposição do cálcio sérico em tecidos sãos, resultante do seu excesso na circulação sanguínea. Isso se dá devido à remoção de cálcio dos ossos, comum em situações de inflamações ósseas, imobilidade, hiperparatireoidismo, hipervitaminose D ou dieta excessivamente rica desse íon. O aumento dos níveis do íon faz com que ele combine com o fosfato e precipite nos tecidos que entram em contato com as altas concentrações calcêmicas. São calcificações metastáticas as do complexo estilohioideo.
sábado, 11 de setembro de 2010
Limite de Hayflick
A maioria das células humanas somáticas (ou seja, já diferenciadas) apresenta normalmente pouca ou nenhuma atividade de telomerase, uma enzima que catalisa a formação dos telômeros que são partes DNA nas extremidades, que não possuem informação genética. Isso significa que, embora essas células contenham o gene que codifica a enzima, ele está silencioso (inativo), não sendo capaz de produzi-la. Portanto, tais células se dividem por apenas 50 a 60 gerações antes que seus telômeros fiquem muito curtos para dar proteção aos cromossomos. Quando alguns desses terminais chegam a um limite mínimo de tamanho (característico para cada célula), isso sinaliza a parada das divisões celulares e o início do envelhecimento.
Esse ponto crítico, conhecido como ‘limite de Hayflick’ (Figura), é uma das razões que explicam por que não podemos viver para sempre! Existem, porém, células normais com alta capacidade proliferativa, como células germinativas jovens (esperma e óvulo não maduros), células-tronco embrionárias e algumas células somáticas. Entre estas estão as células endoteliais (que revestem o coração e os vasos sangüíneos e linfáticos), as células endometriais (que revestem o útero) em adultos e os linfócitos T e B (tipos de glóbulos brancos) quando induzidos à proliferação. Nestas, ao contrário do que ocorre na maioria das células somáticas, a telomerase se mantém ativa.
Relação entre o tamanho dos telômeros e a capacidade de proliferação celular: células germinativas (não diferenciadas – linha amarela) têm telômeros longos e multiplicam-se indeterminadamente, enquanto células somáticas (já diferenciadas – linha laranja) dividem-se por 50-60 gerações e perdem seus telômeros gradualmente (o ‘limite de Hayflick’ é o momento em que a maioria das células somáticas mostra sinais de envelhecimento). Células ‘em crise’ que já acumularam diferentes mutações morrem ou reativam a telomerase, tornando-se ‘imortais’. O encurtamento acelerado dos telômeros (linha roxa) ocorre em muitas síndromes relacionadas ao envelhecimento prematuro. Indivíduos portadores dessas síndromes apresentam precocemente patologias associadas apenas a idosos.
Entretanto, aquelas células que não têm esse poder de proliferação e que transpõem o chamado limite de ‘crise’ reativam a atividade de telomerase e continuam a se dividir indefinidamente. Tais células são consideradas ‘imortais’, e isso é o que acontece com 85% a 90% das células cancerígenas. A atividade ininterrupta da telomerase verificada nas células tumorais também é encontrada na maioria dos eucariotos (organismos cujas células têm núcleo definido) unicelulares. Assim, tais organismos também apresentam uma capacidade infinita de multiplicação quando em condições propícias no meio ambiente ou no hospedeiro, sendo considerados ‘imortais’. Essa condição só pode ser alterada se eles estiverem em meio não adequado para sua sobrevivência.
domingo, 5 de setembro de 2010
Autoimunidade
Pode ser sistêmica ou órgão específica e resulta de uma falha nos mecanismos gerais que mantém tolerância ao próprio somados a fatores que contribuem para o desenvolvimento de autoimunidade (APCs e linfócitos anormais, fundo genético que predispõe, processos inflamatórios e infecções).
Mecanismos de autoimunidade:
- Defeito no mecanismo de deleção clonal (ex: falha na apoptose por anormalidades no FAS ou FAS-L;
- Perda da anergia da célula T: pode ocorrer nos processos inflamatórios, infecções e necrose tecidual, onde se tem APCs ativadas que poderão apresentar antígenos próprios aos linfócitos e expressar moléculas coestimulatórias;
- Ativação policlonal de linfócitos (ex: infecção com produção de superantígenos);
- Reação cruzada entre antígenos próprios e microbianos;
- Liberação de antígenos seqüestrados (ex: processos inflamatórios);
- Defeito na regulação de linfócitos Th1 e Th2;
- Falha do linfócito T supressor;
sábado, 21 de agosto de 2010
ESTEATOSE HEPÁTICA
Esteatose é uma alteração degenerativa reversível que se refere à deposição de gorduras neutras (mono, di e triglicerídios) no citoplasma de células parenquimatosas, também chamada de degeneração, infiltração, metamorfose gordurosa e ainda esteatose de gorduras neutras. É observado com maior freqüência no fígado, principal órgão envolvido no metabolismo lipídico, mas também pode ocorrer no epitélio tubular renal, miocárdio, músculo esquelético e pâncreas. Os fatores que podem causar esteatose são: desnutrição protéica, diabetes mellitus, anemia, difteria, etilismol, intoxicação por tetracloreto de carbono, entre outros.
O acúmulo de gordura ocorre no interior de vacúolos na célula, sendo que em estágios mais avançados há o deslocamento do núcleo para periferia. Macroscopicamente, o fígado aumenta em volume e peso.
Para análise microscópica dos vacúolos com gordura recorre-se a corantes especiais como: sudan IV ou Oil Red-O, os quais coram os lipídios em vermelho-alaranjado. Na coloração com HE (hematoxilina e eosina) os lipídios são perdidos durante o processamento histológico e os vacúolos são identificados por um espaço em branco no interior da célula (imagem negativa).
Esteatose é uma alteração degenerativa reversível que se refere à deposição de gorduras neutras (mono, di e triglicerídios) no citoplasma de células parenquimatosas, também chamada de degeneração, infiltração, metamorfose gordurosa e ainda esteatose de gorduras neutras. É observado com maior freqüência no fígado, principal órgão envolvido no metabolismo lipídico, mas também pode ocorrer no epitélio tubular renal, miocárdio, músculo esquelético e pâncreas. Os fatores que podem causar esteatose são: desnutrição protéica, diabetes mellitus, anemia, difteria, etilismol, intoxicação por tetracloreto de carbono, entre outros.
O acúmulo de gordura ocorre no interior de vacúolos na célula, sendo que em estágios mais avançados há o deslocamento do núcleo para periferia. Macroscopicamente, o fígado aumenta em volume e peso.
Para análise microscópica dos vacúolos com gordura recorre-se a corantes especiais como: sudan IV ou Oil Red-O, os quais coram os lipídios em vermelho-alaranjado. Na coloração com HE (hematoxilina e eosina) os lipídios são perdidos durante o processamento histológico e os vacúolos são identificados por um espaço em branco no interior da célula (imagem negativa).
TUMEFAÇÃO TURVA
As degenerações são alterações morfológicas que uma célula apresenta e se restringem a processos reversíveis. Para as microscopias de TUMEFAÇÃO TURVA, DEGENERAÇÃO HIDRÓPICA E ESTEATOSE HEPÁTICA, o termo degeneração indica as lesões reversíveis decorrentes de alterações bioquímicas que resultam no acúmulo de substâncias no interior das células.
TUMEFAÇÃO TURVA e DEGENERAÇÃO HIDRÓPICA são sinonímias das lesões reversíveis que apresentam a mesma alteração, definindo-se: lesão celular reversível caracterizada pelo acúmulo de água e eletrólitos no interior da célula, tornando-a tumefeita e aumentada de volume.
Na TUMEFAÇÃO TURVA à microscopia ótica as células apresentam-se tumefeitas e são mais turvas.
As degenerações são alterações morfológicas que uma célula apresenta e se restringem a processos reversíveis. Para as microscopias de TUMEFAÇÃO TURVA, DEGENERAÇÃO HIDRÓPICA E ESTEATOSE HEPÁTICA, o termo degeneração indica as lesões reversíveis decorrentes de alterações bioquímicas que resultam no acúmulo de substâncias no interior das células.
TUMEFAÇÃO TURVA e DEGENERAÇÃO HIDRÓPICA são sinonímias das lesões reversíveis que apresentam a mesma alteração, definindo-se: lesão celular reversível caracterizada pelo acúmulo de água e eletrólitos no interior da célula, tornando-a tumefeita e aumentada de volume.
Na TUMEFAÇÃO TURVA à microscopia ótica as células apresentam-se tumefeitas e são mais turvas.
sexta-feira, 13 de agosto de 2010
ISQUEMIAS
Isquemia é definida como sendo o fluxo arterial insuficiente para manter as funções normais teciduais, isto é a diminuição de nutrientes (glicose, oxigênio, proteínas, vitaminas, enzimas, etc) para os tecidos e o retardo na retirada dos metabólitos. A isquemia pode ser total quando o fluxo arterial for insuficiente para manter a vida celular ou tecidual, ou parcial que mantém a viabilidade celular, porém com risco de evoluir para a morte celular, dependendo da nobreza do tecido e do tempo em isquemia. Já a hipóxia é somente a diminuição de oferta de oxigênio aos tecidos, mas, também é lesiva aos tecidos.
A isquemia de membro aguda é qualquer decréscimo agudo ou piora da perfusão do membro causando potencial ameaça à viabilidade da extremidade. A síndrome do dedo azul (blue toe) é um exemplo de isquemia aguda, caracterizada dor súbita, cianose dos pododáctilos e antepé devido à embolia (ateroembolismo) de fonte arterial e que mantém todos pulsos presentes, com oclusão das artérias digitais. Quadro semelhante também pode acontecer para os membros superiores.
Isquemia aguda difusa do membro é caracterizada por dor súbita e progressiva, entorpecimento, enfraquecimento, paralisia da extremidade, acompanhada de palidez, às vezes cianose, esfriamento, e ausência de pulsos. Isquemia aguda é tipicamente causada por embolia para artéria distante da fonte embolígena, ou oclusão de artéria nativa por trombose devida a doença pré-existente ou pós-revascularização.
A isquemia crônica de membro é aquela que apresenta dor ao exercício e alívio em repouso, devida à doença arterial, exemplo claudicação intermitente.
Isquemia crônica crítica de membro deve ser usada para todos doentes portadores de isquemia crônica com dor em repouso de forte intensidade e persistente (por mais de quatro semanas), úlceras ou gangrena, requerendo analgésicos especiais como opiáceos e atribuída objetivamente à doença arterial. A não cicatrização das úlceras deve ser decorrente da isquemia (excluir neuropatia, infecção e outros fatores). A gangrena deve ser conseqüente da isquemia do antepé (excluir os casos de ateroembolismo).
Dor é definida como uma experiência desagradável sensorial e ou emocional, associada a lesões teciduais reais ou potenciais.
Dor em repouso é definida como: a dor em repouso ou isquemia podálica difusa e principalmente localizada no antepé ou pododáctilos, pode se manifestar mais proximal também, mas não poupa as partes distais, devida a isquemia crônica, e não é aliviada com analgésicos comuns. Piora com elevação do membro, é diminuída com o membro pendente e é piorada à noite. A dor é causada pelo fluxo arterial insuficiente para manter a demanda metabólica dos tecidos em repouso.
Cianose fixa é definida como sendo a coloração cianótica das extremidades que não se altera com a mudança de posição ou elevação, devida a isquemia, normalmente não reversível, caracterizando a pré-gangrena.
Gangrena é necrose (morte celular, de tecido ou de órgão) devido à obstrução, ou diminuição do fluxo sangüíneo; pode ser localizada numa pequena área ou comprometer o membro inteiro ou órgão, e pode ser seca (mumificação) ou úmida. Caracterizada por cianose fixa, anestesia dos tecidos envolvidos, progredindo para a necrose (morte tecidual) como resultado da redução do fluxo arterial e sendo insuficiente para o mínimo metabolismo requerido para manter a vida celular.
Úlcera isquêmica é devida à insuficiência de fluxo arterial, ou mínimo trauma de um tecido isquêmico, e que a cicatrização é possível com aumento do fluxo arterial na maioria das vezes requerendo fluxo pulsátil. Essa úlcera normalmente é muito dolorida e está presente mais tipicamente nas extremidades
quinta-feira, 12 de agosto de 2010
MORTE CELULAR: NECROSE VERSUS APOPTOSE
A morte celular, definida como perda irreversível da estrutura e funções vitais da célula, ocorre por dois processos morfologicamente distintos: necrose e apoptose. Sabe-se atualmente que os dois fenômenos contribuem para a morte celular nas doenças hepatobiliares e que a opção da célula por uma dessas formas de morte é influenciada pelo seu estado energético (reserva de ATP). Como processo ativo, a apoptose requer reservas de ATP (pelo menos nas fases iniciais), ao passo que a necrose se instala quando há depleção total do ATP.
A necrose se caracteriza pela perda da integridade da membrana plasmática quanto a sua permeabilidade. Diferentes insultos patológicos como isquemia, hipoxia, hipertermia, irradiação e metabólitos tóxicos podem levar à perda abrupta da integridade da membrana plasmática (citólise) e à alteração de seus gradientes eletroquímicos. Ademais, a liberação dos constituintes intracelulares para o meio extracelular estimulam a resposta inflamatória e ampliam a lesão tecidual. O fenômeno de morte celular por necrose é facilmentem reconhecido nos espécimes de biopsia hepática porque os restos celulares permanecem por longo período antes de serem removidos pelas células inflamatórias. A apoptose é processo ativo cuja marca registrada é a autodigestão controlada dos constituintes celulares, devida à ativação de proteases endógenas e pode ser comparada metaforicamente a um "suicídio celular". A ativação dessas proteases compromete a integridade do citoesqueleto, provocando verdadeiro colapso da estrutura celular. Em resposta à contração do volume citoplasmático, a membrana celular forma bolhas e se altera o posicionamento de seus lipídios constituintes.
Em células indenes a distribuição de fosfatidilserina se faz primariamente no folheto interno da membrana plasmática. Durante o processo de apoptose esse lipídio se expõe no folheto externo da membrana. O novo posicionamento da fosfatidilserina serve como sinalizador para que células fagocíticas das proximidades englobem os fragmentos celulares e completem o processo de degradação. Durante a apoptose ocorrem alterações características no núcleo celular graças à ativação de endonucleases que degradam o DNA. Como resultado, o núcleo torna-se picnótico e a cromatina se condensa nas porções adjacentes à membrana nuclear. Finalmente, o núcleo entra em colapso e se fragmenta.
Simultaneamente, as bolhas que se formam no citoplasma separam a célula em fragmentos circundados por membrana, contendo partes do núcleo e organelas intactas (corpos apoptóticos). Os restos celulares são fagocitados pelos macrófagos teciduais ou células adjacentes. Um dos aspectos que distingue a apoptose da necrose é, nesta, a preservação da integridade da membrana plasmática que evita a liberação dos constituintes celulares para o meio extracelular e, conseqüentemente, a quimiotaxia e a ativação de células fagocíticas. O fenômeno da apoptose é mais difícil de ser detectado nos espécimes de biopsia hepática, pois suas alterações morfológicas se processam rapidamente, entre 2 a 4 horas e os corpos apoptóticos são rapidamente removidos pelos macrófagos teciduais.
Essas peculiaridades justificam a ausência característica de resposta inflamatória no tecido adjacente com preservação do microambiente celular. Em condições patológicas, o grande número de células que sofre apoptose pode suplantar a capacidade fagocitária do fígado. Nessas circunstâncias, os corpos apoptóticos não-fagocitados sofrem processo secundário de necrose, com resposta inflamatória. Portanto, nessas circunstâncias, a elevação dos níveis séricos de aminotransferases pode ser observada, refletindo tanto aumento da apoptose, como necrose hepatocelular.
quarta-feira, 4 de agosto de 2010
PATOLOGIAS DA IMUNIDADE
O termo hipersensibilidade é aplicado quando uma resposta adaptativa ocorre de forma exagerada ou inapropriada, causando reações inflamatórias e dano tecidual. A hipersensibilidade é uma característica do indivíduo e não se manifesta no primeiro contato com o antígeno indutor da reação de hipersensibilidade, mas geralmente aparece em contatos subseqüentes.
De acordo com a definição de Coombs e Gell, as reações de hipersensibilidade podem ser divididas didaticamente em quatro tipos (I, II, III e IV). É preciso dizer que, in vivo, estas reações não ocorrem isoladamente. Os três primeiros tipos são mediados por anticorpos, enquanto que o quarto tipo é mediado primariamente por células T e macrófagos.
A Hipersensibilidade tipo I, também chamada Anafilática ou Hipersensibilidade Imediata. É uma reação imune desenvolvida rapidamente, ocorrendo em um tempo de 5 a 30 minutos depois da combinação do antígeno com o anticorpo ligado a mastócitos em indivíduos previamente sensibilizados por esse antígeno exógeno. O principal anticorpo envolvido é a IgE. Há transferência de anticorpos e expressão de eczema. Histologicamente há acúmulo de células leucocitárias (neutrófilos, basófilos e eosinófilos).
Exemplos de Hipersensibilidade tipo I: asma brônquica, rinite alérgica, alergias de pele, urticária, febre do feno, gastroenterite alérgica.
A Hipersensibilidade tipo II (citotóxico anticorpo dependente). É mediada por anticorpos IgG e IgM diretamente contra antígenos presentes na superfície de células ou outros componentes teciduais. Os determinantes antigênicos podem estar no interior da membrana celular ou estar absorvido à sua superfície, como metabólitos de drogas. Em qualquer caso, a reação resulta da ligação do anticorpo a um antígeno de superfície celular normal ou alterada.
A resposta é mais lenta, se instalando entre 2 e 24 horas depois do contato, sem que haja exposição adicional ao antígeno e pode durar por vários dias.
Exemplos de Hipersensibilidade tipo II: Eritroblastose fetal, Síndrome de Goodpasture, Miastenia grave.
A Hipersensibilidade tipo III é induzida por complexos antígeno-anticorpo que produzem lesão tecidual como resultado de sua capacidade de ativar o sistema complemento. A reação tóxica é iniciada quando o antígeno se liga ao anticorpo, tanto na circulação, quanto em locais extravasculares onde o antígeno possa estar precipitado. Os complexos formados na circulação produzem lesão tecidual principalmente quando ocorrem nas paredes dos vasos ou em estruturas filtrantes, como nos glomérulos renais.
Exemplos de Hipersensibilidade tipo III: Lúpus eritemastoso sistêmico, glomerulonefrite.
A Hipersensibilidade tipo IV (mediada por células) é um tipo de resposta imune exagerada de origem leucocitária, principalmente de monócitos e linfócitos T. Nesta reação há uma superestimulação da quimiotaxia dessas células, fazendo com que haja uma superpopulação de leucócitos em determinada região. Essa estimulação, feita pelas APCs (células apresentadoras de antígenos), torna-se sem controle e o que há é uma contínua atração celular pela expressão de moléculas de adesão e fatores quimiostáticos (como fatores de crescimento).
Os monócitos ativados sofrem alterações: aumentam de tamanho, aumentam seu metabolismo, aumentam sua capacidade de fagocitar e matar microorganismos, facilitam a apresentação de antígenos, estimulam a proliferação de fibroblastos etc. Portanto, os monócitos ativados (macrófagos) servem para eliminar o antígeno agressor e, se sua ativação persistir,, provocam fibrose e necrose tecidual.
Exemplos de Hipersensibilidade tipo IV: Doenças granulomatosas, Tireoidite de Hashimoto.
Assinar:
Postagens (Atom)